Los modelos atomicos fueron los experimentos de varios cientificos con la finalidad de describir la estructura del átomo. Basicamente son las formas en las que se interpreta o representa el comportamiento del átomo. No son estructuras estables, pueden cambiarse o desecharse si ya no cumplen la función para la cual fueron propuestos.
Existen distintas teorías del
modelo atómico:
 1) Modelo Atómico de Democrito (Teoría atómica del universo) (400 años a.C.):
Plantea que la materia esta formada por particulas diminutas, invisibles e indestructibles a las cuales llamó
ATOMOS= SIN DIVISIÓN. Llego a estas conclusiones por deducción sin efectuar ningun experimento
1) Modelo Atómico de Democrito (Teoría atómica del universo) (400 años a.C.):
Plantea que la materia esta formada por particulas diminutas, invisibles e indestructibles a las cuales llamó
ATOMOS= SIN DIVISIÓN. Llego a estas conclusiones por deducción sin efectuar ningun experimento
2) Modelo Atómico de Dalton (1808):
Primer modelo de átomo con base científica, todos sus postulados fueron publicados en un libro llamado ''Nuevo sistema de filosofia quimica'' en el cual decia lo siguiente:
 1.- Toda materia esta formada por particulas pequeñas llamadas atomos
2.- Los atomos no se pueden dividir ni romper
3.- Los atomos de un mismo elemento son iguales entre si, tienen la misma masa, peso y dimensiones
4.- Los atomos se pueden combinar para formar compuestos quimicos, guardan relaciones simples
5.- Los atomos de elementos diferentes se combinan en distintas proporciones y forman mas de un compuesto
6.- Los compuestos quimicos se forman al unirse atomos de dos o mas elementos diferentes
3) Modelo Atomico de Thomson (1904):
1.- Toda materia esta formada por particulas pequeñas llamadas atomos
2.- Los atomos no se pueden dividir ni romper
3.- Los atomos de un mismo elemento son iguales entre si, tienen la misma masa, peso y dimensiones
4.- Los atomos se pueden combinar para formar compuestos quimicos, guardan relaciones simples
5.- Los atomos de elementos diferentes se combinan en distintas proporciones y forman mas de un compuesto
6.- Los compuestos quimicos se forman al unirse atomos de dos o mas elementos diferentes
3) Modelo Atomico de Thomson (1904):
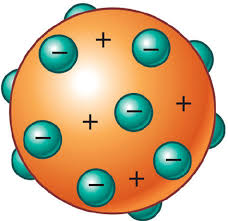 En esta teoria descubrió una particula subatómica a la cual llamo electrón, que constaba de cargas negativas y se encontraban alrededor del atomo el cual esta cargado positivamente, como un budin de pasas
En esta teoria descubrió una particula subatómica a la cual llamo electrón, que constaba de cargas negativas y se encontraban alrededor del atomo el cual esta cargado positivamente, como un budin de pasas
4) Teoría del átomo cúbico de Lewis

Esta teoría fue planteada por Gilbert N.Lewis en 1902, Es
uno de los primeros modelos atómicos descritos en el cual los electrones del átomo se
encuentran en diferentes posiciones. Este modelo sirvió para poder dar cuenta del fenómeno de la
valencia, aquí, los electrones de valencia se encuentran ubicados en los
vértices de un hipotético cubo, que de otra forma representa el átomo.
Según la teoría de Lewis los enlaces
covalentes se encontrarían formando dos átomos, cuando estos comparten
una arista es decir que los electrones son compartidos por ambos átomos
Por otra parte los enlaces ionicos se hallarían formados cuando un cubo cede un electrón y otro lo gana sin compartir aristas
(A) Representación de enlaces ionicos
(B)Representa un enlace intermedio, cuando los cubos comparten un vértice.
(C) Representación de enlaces covalentes
5)Modelo atómico de Rutherford
 Fue propuesto por el químico y físico británico-neozelandés Ernest Rutherford en el año 1911. Es una teoría sobre la estructura interna del átomo que explica los resultados de su experimento de la lámina de oro, lo cual concluye lo siguiente: El atomo esta conformado por dos partes: el nucleo y la corteza.
Fue propuesto por el químico y físico británico-neozelandés Ernest Rutherford en el año 1911. Es una teoría sobre la estructura interna del átomo que explica los resultados de su experimento de la lámina de oro, lo cual concluye lo siguiente: El atomo esta conformado por dos partes: el nucleo y la corteza.

El núcleo: Es de pequeño tamaño , la parte central del atomo donde se encuentra la masa y toda la carga positiva del atomo.
La corteza: Es mas grande en relacion con las dimensiones del nucleo, es casi un espacio vacio. Lo que quiere decir que la mayor parte de las particulas alfa atraviesan la lamina de oro sin desviarse ,aquí se encuentran los electrones con masa muy pequeña y carga negativa.
6) Modelo atómico de Bohr
Fue propuesto por el fisico danés Niels Bohr en el año 1913. Se basó en el átomo de hidrógeno. Describió a este con un protón en el núcleo, y girando a su alrededor un
electrón. Los electrones giran en órbitas circulares alrededor del
núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana
posible al núcleo. Bohr supuso que los electrones solamente se podían mover en
órbitas específicas, cada una de las cuales caracterizada por su nivel
energético.
Postulados:
1)Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía
2)Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p.
3)Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
7)Modelo Atómico de Sommerfeld
 Fue planteado por el físico Arnold Sommerfeld en 1916, para mejorar algunos aspectos del modelo atómico de Bohr ayudándose de la relatividad de Einstein. El modelo de Bohr funcionaba perfectamente para el átomo de hidrógeno, no así para otros átomos ,donde se veía claramente que los electrones de un mismo nivel energético poseían diferentes energías, por lo cual existia un error en aquel modelo.Concluyo que el movimiento de los electrones se podia explicar demostrando que dentro de un mismo nivel de energía existían distintos subniveles energéticos es decir, energías ligeramente diferente.
Como conclusion estas son las mejoras del modelo de bohr:
Fue planteado por el físico Arnold Sommerfeld en 1916, para mejorar algunos aspectos del modelo atómico de Bohr ayudándose de la relatividad de Einstein. El modelo de Bohr funcionaba perfectamente para el átomo de hidrógeno, no así para otros átomos ,donde se veía claramente que los electrones de un mismo nivel energético poseían diferentes energías, por lo cual existia un error en aquel modelo.Concluyo que el movimiento de los electrones se podia explicar demostrando que dentro de un mismo nivel de energía existían distintos subniveles energéticos es decir, energías ligeramente diferente.
Como conclusion estas son las mejoras del modelo de bohr:
 1)Los electrones se mueven alrededor del nucleo en órbitas de forma circular
2)En el segundo nivel energético existen dos o mas subniveles en el mismo nivel
3) El electrón es una corriente electrica minúscula
1)Los electrones se mueven alrededor del nucleo en órbitas de forma circular
2)En el segundo nivel energético existen dos o mas subniveles en el mismo nivel
3) El electrón es una corriente electrica minúscula
 8) Modelo atomico de Schrödinger
Este es un modelo cuantico basada en la ecuación que el mismo Schrodinger hizo en 1925. En un comienzo describía a los electrones como ondas de materia tambien la ecuacion ondulatoria que explicaba el desarrollo en el tiempo y el espacio de la onda material, la ecuacion involucra:
- La funcion de onda que es una funcion en la cual se concentra toda la informacion de un sistema.
Un operador matemático en este caso el hamilton que se construye con elementos de mecanica cuantica
--La energía que es el valor que normalmente se desea conocer .
8) Modelo atomico de Schrödinger
Este es un modelo cuantico basada en la ecuación que el mismo Schrodinger hizo en 1925. En un comienzo describía a los electrones como ondas de materia tambien la ecuacion ondulatoria que explicaba el desarrollo en el tiempo y el espacio de la onda material, la ecuacion involucra:
- La funcion de onda que es una funcion en la cual se concentra toda la informacion de un sistema.
Un operador matemático en este caso el hamilton que se construye con elementos de mecanica cuantica
--La energía que es el valor que normalmente se desea conocer .
*La formula es la siguiente:
H (Phy) = E (Phy)
donde H es el Hamiltoniano
(Phy) la función de onda
E la energía







